Les atomes, tout le monde en a entendu parler. On sait qu’ils existent, je vous raconterai une autre fois comment on en est devenu convaincu. Ce que je peux dire c’est que c’était au 19ème siècle et qu’à cette époque il n’y avait aucun moyen de se convaincre de leur existence en les voyant. Cela a d’ailleurs donné lieu a beaucoup de querelles scientifiques et philosophiques (faut-il voir pour savoir ?). Il n’empêche qu’une bonne partie du formidable progrès scientifique du 20ème siècle s’est construite sur le fait que les atomes existent sans pour autant que quiconque les ai vus.
Aujourd’hui, au 21ème siècle, peut-on enfin voir les atomes? Si on assimile un atome à une sphère, elle aurait un diamètre de l’ordre du dixième de milliardième de mètre, un cheveu que l’on couperait un million de fois, un ångström si vous préférez… Mais j’imagine que ce genre de dimension n’est pas très facile à se représenter ? Disons que cela est suffisamment petit pour qu’aucun microscope optique ne soit assez puissant pour distinguer un atome. Alors, a-t-on jamais vu un atome ?
La réponse est oui,
même si le verbe « voir » est sans doute mal choisit.
Pour « voir » des atomes, on peut, par exemple, utiliser un microscope électronique en transmission (MET pour les intimes, voire TEM in english).
Le principe d’un microscope électronique est d’utiliser des électrons à la place de la lumière. Ce microscope est dit « en transmission » parce que le faisceau d’électrons va traverser le matériau observé.
Les premiers microscopes électroniques ont été imaginés dans les années 1930 notamment par Ernst Ruska qui obtient le prix Nobel de Physique en 1986 pour « son travail fondamental en optique électronique, et pour la conception du premier microscope à électrons.
Cette vidéo (trouvée là) explique le fonctionnement de manière un peu plus détaillé.

Voici une image réalisée en MET d’un empilement de cuivre (Cu) sur de l’oxyde de manganèse (MnO).
Chaque petit point clair est un atome. On a l’impression que les atomes de MnO sont plus gros que les atomes de Cu… Sauf que Les atomes de MnO n’existent pas, il y a des atomes de Mn et des atomes d’O… et il n’est pas possible de les distinguer sur cette photo.
Les atomes sont tellement bien arrangés périodiquement que lorsque les électrons passent à travers ce matériau, ils subissent un trajet un peu particulier. On dit qu’ils ont été diffractés. Finalement grâce au MET, ce que l’on « voit » ce n’est pas directement les atomes mais la manière dont ils sont organisés. Surtout, juste avec cette image, il n’est absolument pas possible de dire avec certitude de quel atome il s’agit.
Source : https://t.co/Ee0tPAdEB1

Sur cette image-ci, la nanoparticule est très structurée : on voit bien ce quadrillage typique d’une très grande organisation. Cette organisation s’appelle un cristal. Les petits chiffres entre accolades sont une notation utilisée en cristallographie pour se repérer dans l’orientation du cristal.
En revanche, sous la nanoparticule il y a une espèce de brouillard. Cette texture montre qu’il y a de la matière et mais comme elle est désorganisée il n’est plus possible de distinguer les atomes qui la composent.
source : https://bit.ly/2GR4V25
Un autre exemple de microscope qui permet de « voir » des atomes est le microscope à effet tunnel, que l’on appelle plus souvent par son acronyme anglais STM (Scanning Tunneling Microscope). Le principe est de balader une pointe à très grande proximité de la surface du matériau qui nous intéresse. Le courant électrique entre le matériau et la pointe est mesuré, c’est un courant un peu particulier car la pointe ne touche jamais la surface. La pointe est tellement proche (environ 1 nanomètre) que les électrons ont une certaine probabilité de passer du matériau à la pointe ! Ce phénomène est appelé « effet tunnel » et il dépend fortement de la réserve d’électrons disponible dans le matériau.
Une petite animation sur le fonctionnement du STM est disponible ici

Finalement, le STM donne accès à la probabilité de trouver un électron à un endroit. Comme il y a des électrons dans les atomes ça donne une idée de la forme d’un atome. Par exemple ici, vous pouvez admirer une image d’une surface d’or où l’on voit bien des petites boules organisées.
Cette image a beau ressembler aux images de MET, elle ne donne pas du tout les mêmes informations.
source (et d’autres images de STM) : https://bit.ly/2UnVmQq

D’ailleurs une manière de se rendre compte de la différence entre STM et MET est de s’amuser avec les atomes. Ici, il y a 48 atomes de fer sur une surface de cuivre. L’interaction des électrons de chacun des atomes va provoquer ces espèces de ronds dans l’eau et cette couronne de montagnes que l’on appelle « quantum corral »
La densité d’électrons est plus importantes sur les atomes de fer si bien qu’ils n’ont plus du tout l’air sphériques !
Source : https://bit.ly/37Vwgw2
Pour finir, voici l’une des images scientifiques que je trouve la plus extraordinaire.
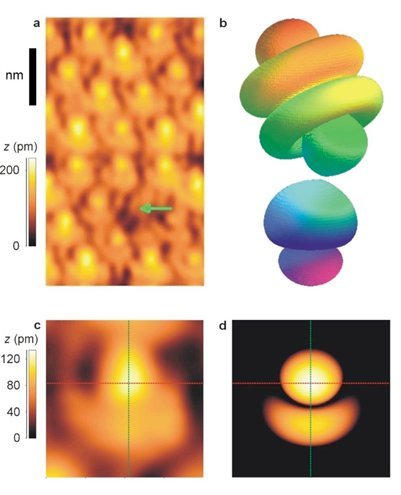
C’est toujours en STM et il y a déjà quelques années que cette image a été publiée.
Ces images sont exceptionnelles parce que l’on y voit des atomes qui ont des formes qui peuvent paraitre très étranges. En réalité il n’en est rien.
On sait depuis des décennies que les électrons ne tournent pas autour du noyau atomique comme dans un système planétaire. Les électrons sont à la fois des ondes et des particules qui décrivent des orbites aux formes variées. Les équations de la mécanique quantique permettent de simuler ces formes mais personne jusque-là n’avait obtenu de preuve expérimentale.
Absolument splendide !
Source : https://bit.ly/2vNsIO
Il existe quelques autres techniques qui permettent de « voir » les atomes, mais, vous l’aurez compris maintenant, le mot « voir » n’est pas du tout approprié. La formation et l’expérience des physiciens et physiciennes leur permettent de voir au-delà de l’image brute. Ce regard éclairé est la toute première étape de l’analyse des résultats qui permettra de comprendre un peu plus comment la matière est formée.